Ley de la conservación de la materia
Como hecho científico
la idea de que la masa se conserva se remonta al químico Lavoisier,
el científico francés considerado padre de la Química moderna que midió cuidadosamente la
masa de las sustancias antes y después de intervenir en una reacción química, y
llegó a la conclusión de que la materia, medida por la masa, no se crea ni
destruye, sino que sólo se transforma en el curso de las reacciones. Sus
conclusiones se resumen en el siguiente enunciado: En una reacción química, la materia
no se crea ni se destruye, solo se transforma. El mismo principio fue descubierto
antes por Mijaíl Lomonosov, de manera que es a veces
citado como ley de Lomonosov-Lavoisier, más o menos en los siguientes términos: La masa de un sistema de sustancias
es constante, con independencia de los procesos internos que puedan afectarle,
es decir, "La suma de los productos, es igual a la suma de los reactivos,
manteniéndose constante la masa". Sin embargo, tanto las técnicas modernas
como el mejoramiento de la precisión de las medidas han permitido establecer
que la ley de Lomonosov-Lavoisier, se cumple sólo aproximadamente.
La equivalencia entre
masa y energía descubierta por Einstein obliga a rechazar la afirmación de que
la masa convencional se conserva, porque masa y energía son mutuamente
convertibles. De esta manera se puede afirmar que la masa realitivista equivalente (el
total de masa material y energía) se conserva, pero la masa en reposo puede cambiar,
como ocurre en aquellos procesos relativísticos en que una parte de la materia
se convierte en fotones. La conversión en reacciones nucleares de una parte de la materia en energía
radiante, con disminución de la masa en reposo; se observa por ejemplo en
procesos de fisión como la explosión de una bomba atómica,
o en procesos de fusión como la emisión constante de energía que realizan las estrellas.
En el momento de ocurrir un cambio
físico o químico (reacción química) en una sustancia, ¿existe perdida de masa
y/o energía?
Antoine Laurent Lavoiser (743-1749) y
James Prescott Joule (1818-1889), dedicaron parte de su trabajo científico en
la solución de este problema, llegando a la conclusión de que en las reacciones
químicas y en los cambios físicos las masas de las sustancias participantes no
se crean ni destruyen, solo se transforman; esta conclusión se conoce con el
nombre de Ley de la conservación de la masa.
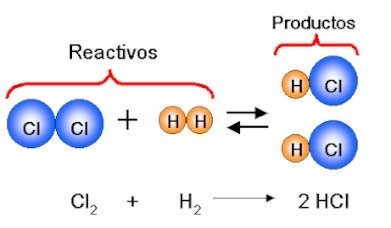
Ejemplo de la ley de la conservación
de la materia: formación del ácido clorhídrico, mediante la reacción del
Hidrógeno con el Cloro
141.812 g + 4.032 g 145.844 g
En este ejemplo de reacción química, 4.032 g de Hidrógeno gaseoso, reaccionan con 141.812 g de cloro gaseoso, para formar 145.844 g de ácido clorhídrico.
La suma de los reactivos es igual a la suma de los productos.La masa de los reactivos no se destruyó, estos se combinaron y se transformaron en una nueva sustancia.
No hay comentarios:
Publicar un comentario